De grenzeloze toekomst van RNA
RNA is in een recordtempo naar de voorgrond van de farmaceutische wereld gesprongen. Door aan te grijpen op de basisprocessen in onze cellen, kan het onze gezondheid beschermen of herstellen. Wat gaat RNA betekenen voor medische behandelingen in de toekomst?
Terwijl in heel Nederland mensen de mouwen opstropen voor hun boostervaccin, daagt bij velen het besef dat innovatieve ontwikkelingen in de farmaceutische industrie ons in nood van grote dienst kunnen zijn. Uit de meer dan 150 coronavaccins die vorig jaar in ontwikkeling waren, hebben de RNA-vaccins – de vaccins van Pfizer-BioNTech en Moderna – toch wel de grootste successen geboekt. Het onderzoek naar RNA is al decennialang gaande, tegenslagen waren er te over, maar door een samenloop van omstandigheden konden onderzoekers vorig jaar eindelijk een veilig en werkzaam product afleveren. Corona zette het allemaal in gang.
Ook als het coronavirus de komende maanden weer wegebt, dan zullen de RNA-vaccins blijven. Ondertussen kijken onderzoekers naar andere manieren om RNA in te zetten, bijvoorbeeld om erfelijke ziekten te behandelen, of om het immuunsysteem tegen kankercellen in te schakelen. Hoe breed is die inzetbaarheid eigenlijk? Is RNA inderdaad het gouden zwaard waarmee men ziekte en kwalen de wereld uit kan slaan?
Boodschappenlijst
RNA staat voor ribonucleïnezuur. Het is een groot molecuul dat van nature voorkomt in alle levende cellen. RNA kan uitgelegd worden als het boodschappenlijstje waarmee een cel eiwitten maakt. Een klein stukje van het DNA – ons genetisch materiaal – wordt in de celkern overgeschreven naar een kopie. Deze kopie zal naar het cytoplasma gaan en daar als recept fungeren voor de synthese van eiwitten, de bouwstenen en katalysatoren van de cel. Een levercel maakt andere lijstjes dan een spiercel of een hersencel: op basis van de code in het RNA worden eiwitten geproduceerd die een specifieke functie vervullen waar op dat moment behoefte aan is. Bij RNA-vaccins en RNA-geneesmiddelen leggen we er in wezen gewoon één boodschappenlijstje bij.
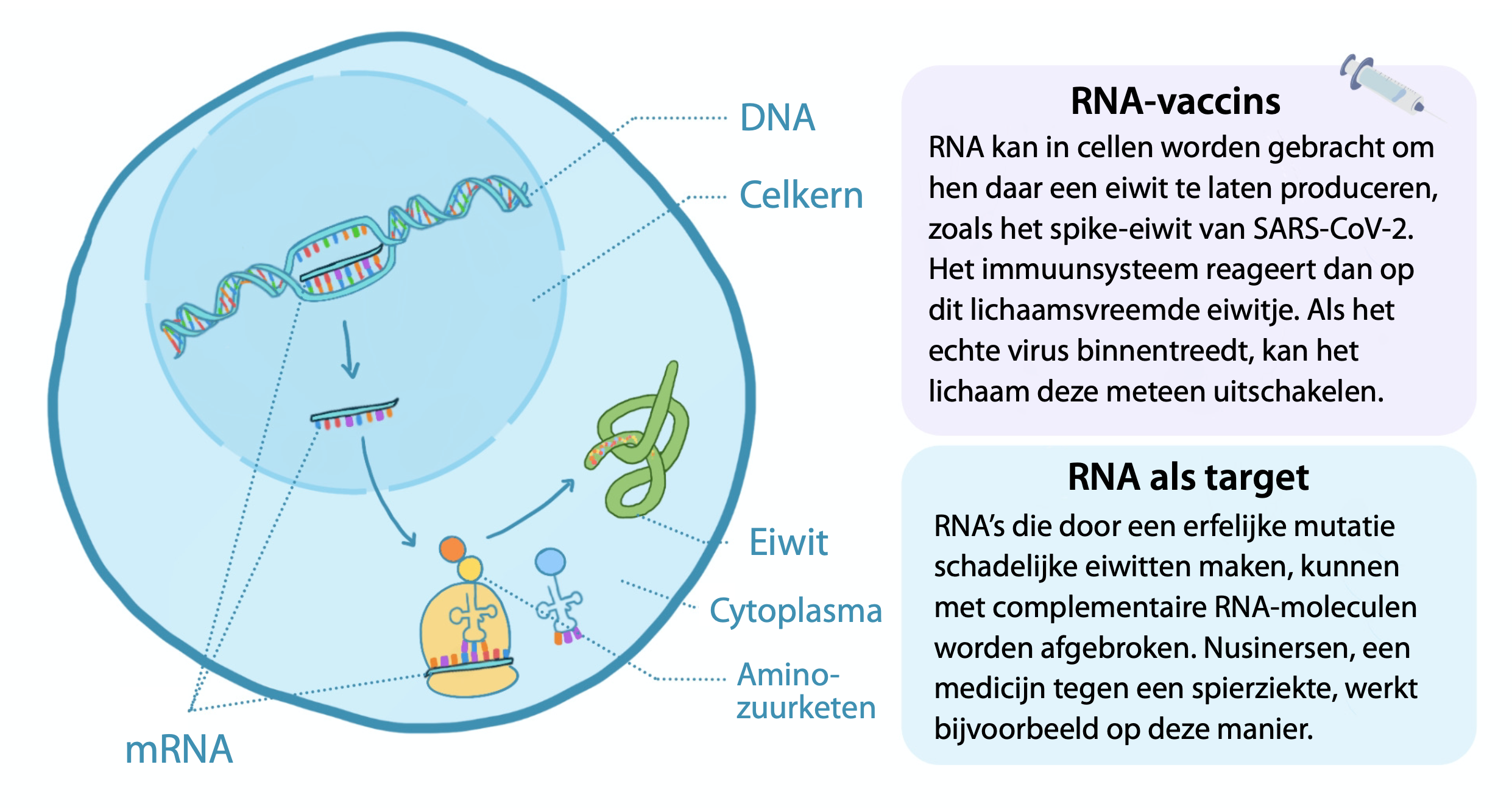
Veel wetenschappers geloven dat RNA-therapeutica een enorme impact zullen hebben op de gezondheidszorg van de eenentwintigste eeuw. Sommigen spreken zelfs van een RNAissance; de gedachte om RNA te gebruiken was er al een tijdje, maar pas onlangs lijken farmaceutische bedrijven overtuigd geraakt van de mogelijkheden. Alleen al in de afgelopen vijf jaar zijn meer dan honderd therapieën met RNA-moleculen onderzocht in klinische trials. Het is slechts een kwestie van tijd totdat er nieuwe RNA-gebaseerde medicijnen op de markt komen. Spierziekten, hartziekten en sommige vormen van kanker zitten nu voorop in de pipeline, zoals onlangs werd beschreven in het Nederlands Tijdschrift voor de Geneeskunde.
Doorzettingsvermogen
De fundamenten van RNA-therapieën zijn gelegd door de Hongaarse biochemica Katalin Karikó. Zij ontdekte, in samenwerking met de Amerikaanse immunoloog Drew Weissman, dat RNA zo aangepast kan worden dat het zonder ontstekingsgevaar in het lichaam kan worden geïnjecteerd. De truc was het modificeren van bepaalde nucleotiden (bouwstenen van het RNA-molecuul).
Haar geduld en doorzettingsvermogen in het licht van alle tegenslagen wekken ontzag. Nog steeds zet ze zich in voor het optimaliseren van RNA dat in het lichaam een gezondheidsbevorderend product maakt – en dat kan van alles zijn, ook stofjes die het immuunsysteem inschakelen tegen kankercellen bijvoorbeeld. Je eigen lichaam een medicijn laten maken, door gewoon wat RNA in injecteren, zou onderzoekers in staat kunnen stellen een enorm scala aan ziekten te behandelen.


Krachten bundelen
De invloed van ontluikende RNA-technologieën is ook in Leidse kringen voelbaar. Leo Visser, afdelingshoofd infectieziekten in het LUMC, kijkt op van het tempo waarmee RNA-vaccins het tij van de farmaceutische markt lijken te keren. “De combinatie van politieke wil, financiële mogelijkheden en wetenschappelijke samenwerking maakt dat je enorme stappen kunt zetten.” De kennis die achter de schermen wordt vergaard is daarbij doorslaggevend. “Zonder de inzichten van Katalin Karikó hadden we de vaccins niet gehad.”
Visser doet onderzoek naar vaccinatie en immuunresponsen tegen tropische pathogenen, in het bijzonder gelekoorts- en rabiësvaccinatie. Zijn team is geïnteresseerd in het vinden van alternatieve toedieningsroutes om zuiniger gebruik te maken van de vaccins. “Met zo weinig mogelijk vaccin zoveel mogelijk mensen bereiken”, is het streven. Een slimme manier om dit te doen is niet in de spier, maar in de huid te prikken. “Precies in de huidlaag waar veel antigeenpresenterende immuuncellen zitten. Dan heb je minder vaccin nodig, maar de bescherming is alsnog voldoende hoog.”


Waarom is RNA nou juist zo interessant? Dat heeft te maken met de vele voordelen. Het molecuul is relatief eenvoudig op grote schaal te produceren, snel aan te passen wanneer onverwachte (virus)varianten de kop opsteken, en bovendien zeer goed te personaliseren.
Visser: “Met RNA heb je bijvoorbeeld de mogelijkheid een combinatievaccin te maken die meerdere antigenen laat produceren (in plaats van één spike-eiwit dat het virus zo weer verandert, red). Zulke vaccins zijn dan geschikt tegen veel verschillende varianten van een ziekteverwekker, en dat is een oud streven in de vaccin-industrie.” Uiteraard is er nog veel werk aan de winkel voor verbetering. “Het RNA stabieler maken, beter richten op bepaalde cellen in het lichaam, makkelijker opslaan, daar is nog veel winst te halen.”
Antisense
Uiteraard is RNA meer dan alleen een vaccin-ingrediënt. Het is in de eerste plaats de vertolker van al onze genen, en speelt als zodanig een fundamentele rol in ziekte en gezondheid. Mutaties in het erfelijk materiaal hebben soms tot gevolg dat er 'verkeerde' of 'misgecodeerde' RNA-moleculen worden gemaakt in de lichaamscellen. Sommige hiervan kunnen desastreuze gevolgen hebben voor de gezondheid.
Willeke van Roon-Mom, hoogleraar humane genetica en hoofd van het Dutch Centre for RNA Therapeutics (DCRT) in Leiden, doet onderzoek naar de ontwikkeling van specifieke RNA-therapieën tegen dat soort erfelijke ziekten. Haar carrière staat in het teken van erfelijke hersenziekten die veroorzaakt worden door schadelijke (toxische) eiwitten. “Wat wij hier doen is het vinden van manieren om de RNA-moleculen die voor die eiwitten coderen, af te breken. Hiervoor maken we gebruik van zogenaamde antisense oligonucleotiden.” Door nauw samen te werken met patiënten, clinici en bedrijven, maakt het DCRT zich hard voor de ontwikkeling van therapieën tegen zeer zeldzame aandoeningen. “Aandoeningen die bij grote farmaceuten vaak minder kans maken”, legt van Roon uit.
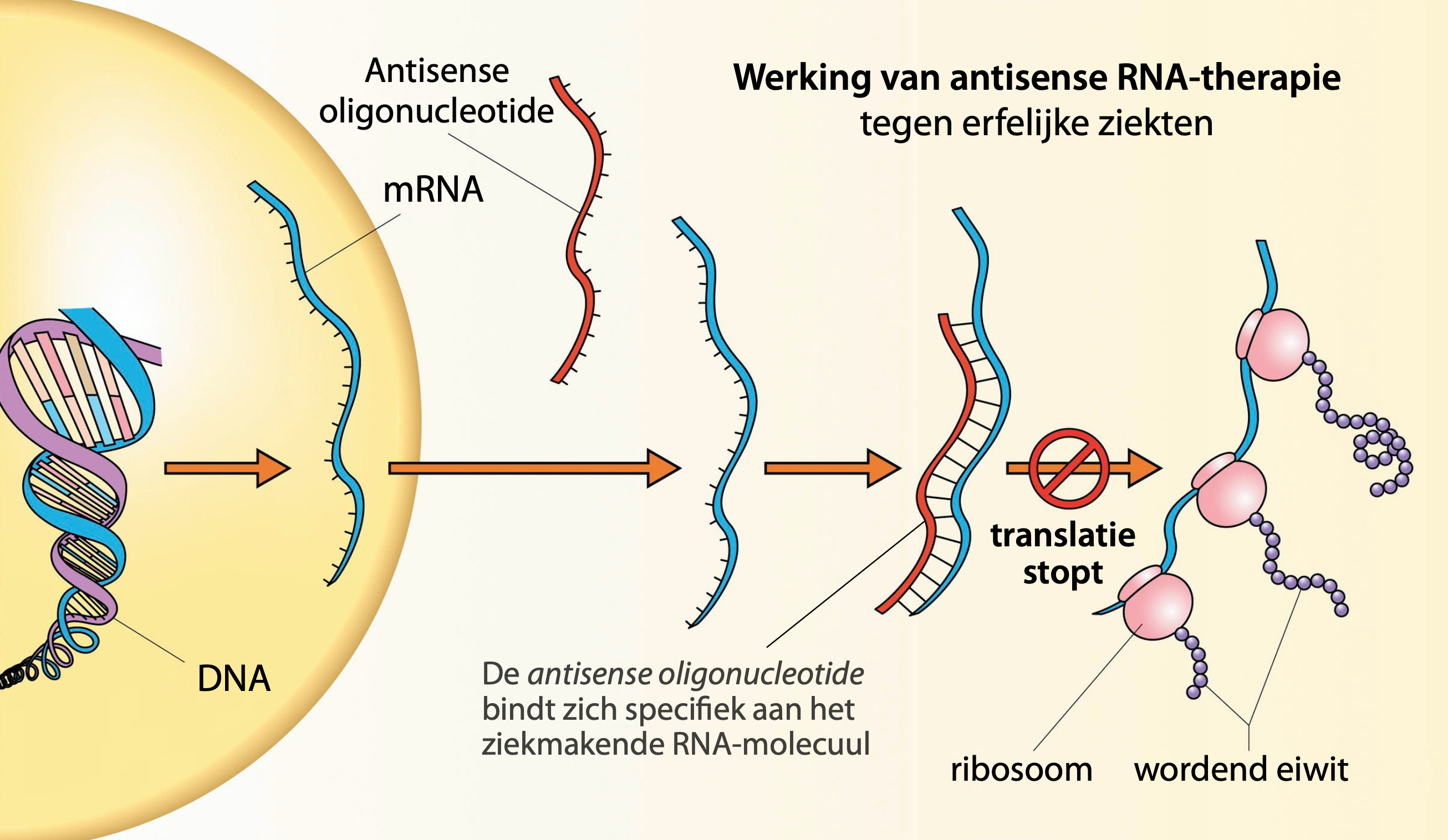
Dit is dus een hele andere toepassing dan RNA-vaccins: hier wordt RNA zo geconstrueerd dat het specifiek aan de ziekmakende RNA-moleculen bindt, en deze afbreekt, om zo de expressie van toxische eiwitten tegen te gaan. Van Roon: “Een fundamenteel probleem is dat je hiermee de ziekte weliswaar kan verzachten of vertragen, maar niet genezen. Daarvoor zou je eigenlijk stap verder moeten kijken, naar de DNA-modificerende technieken.”
Dat neemt niet weg dat er op dit moment allerlei RNA-gebaseerde technieken in ontwikkeling en gebruik zijn die de gezondheid van patiënten goed kunnen herstellen. “Het veld is al zo breed. Splice-modulatie, downregulatie, interferentie.. Ik verwacht dat we in al deze toepassingen nog grote stappen gaan maken, en ik hoop dat we komende jaren meer te weten komen over hoe de effectiviteit nog hoger te krijgen, terwijl we bijwerkingen laag houden. Ook klinische trials die minder succesvol blijken, kunnen zeer waardevolle inzichten hierover geven.”



0 Reacties
Geef een reactie